¡BUENAS AMIGOS!
Hoy os vamos a hablar, como tema 1 º de este blog, de lo estados de agregación de la materia.
En física y química se observa que, para cualquier sustancia o elemento material, modificando sus condiciones de temperatura o presión, pueden obtenerse distintos estados o fases, denominados estados de agregación de la materia, en relación con las fuerzas de unión de las partículas (moléculas, átomos o iones) que la constituyen.
Todos los estados de agregación poseen propiedades y características diferentes, los más conocidos y observables cotidianamente son cinco, las llamadas fases sólida, líquida, gaseosa, plasmática y condensado.
En el siguiente dibujo podemos observar los principales estados que podremos encontrar a la materia.
Las principales características de estos estados son:
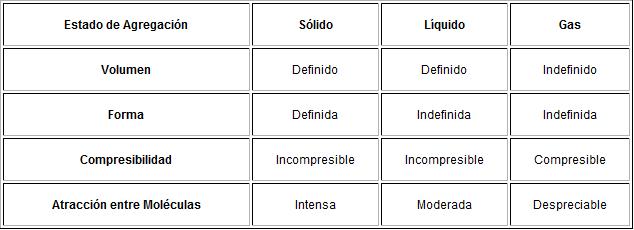
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
Toda esta información, se podría resumir en una sencilla tabla que os enseñaremos a continuación.
Sobre la teoría cinética podemos decir, la teoría cinética de los gases es una teoría física y química que explica el comportamiento y propiedades macroscópicas de los gases a partir de una descripción estadística de los procesos moleculares microscópicos. La teoría cinética se desarrolló con base en los estudios de físicos como Ludwig Boltzmann y James Clerk Maxwell a finales del siglo XIX.
Los principales teoremas de la teoría cinética son los siguientes:
- El número de moléculas es grande y la separación media entre ellas es grande comparada con sus dimensiones. Por lo tanto ocupan un volumen despreciable en comparación con el volumen del envase y se consideran masas puntuales.
- Las moléculas obedecen las leyes de Newton, pero individualmente se mueven en forma aleatoria, con diferentes velocidades cada una, pero con una velocidad promedio que no cambia con el tiempo.
- Las moléculas realizan choques elásticos entre sí, por lo tanto se conserva tanto el momento lineal como la energía cinética de las moléculas.
- Las fuerzas entre moléculas son despreciables, excepto durante el choque. Se considera que las fuerzas eléctricas o nucleares entre las moléculas son de corto alcance, por lo tanto solo se consideran las fuerzas impulsivas que surgen durante el choque.
- El gas es considerado puro, es decir todas las moléculas son idénticas.
- El gas se encuentra en equilibrio térmico con las paredes del envase.
